Los mecanismos y procesos moleculares y celulares que explican la contracción muscular en el músculo estriado ocurren en el sarcómero de la miofibrilla. La comprensión de ellos depende del entendimiento de la organización de la estructura del sarcómero. En un experimento imaginario armemos primero un sarcómero ideal.
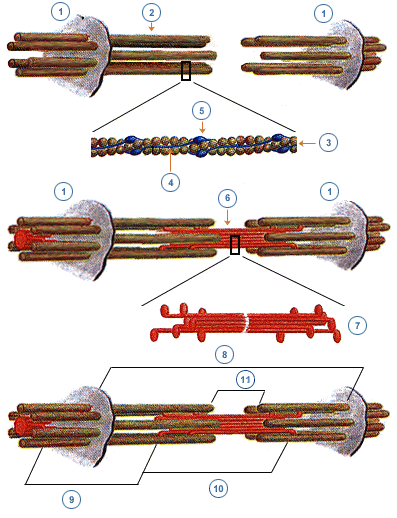
- Recordemos que la miofibrilla es un conjunto de compartimientos cilíndricos que se van ubicando uno al lado del otro, constituyendo un cilindro alargado. Cada uno de esos cilindros es un sarcómero y limita con su vecino por una línea o banda llamada, línea o banda z.
- A cada lado de la línea z se insertan filamentos cilíndricos delgados que son los filamentos de actina. Cada filamento de actina esta formado por una doble hebra de moléculas de actina que se enrollan una sobre la otra. En esta organización la actina se denomina actina F.
Cada filamento de actina esta constituido por unas 400 unidades de actina-G, que es una proteína globular con un peso molecular de alrededor de 42 kDa.
- En el centro del sarcómero se insertan filamentos gruesos, de miosina. Cada uno de estos filamentos está formado por 150 a 360 moléculas de miosina.
- En el recuadro en el filamento grueso, vemos que cada molécula de miosina presenta una cola formada por dos fibras alargadas de meromiosina, que es una variedad de miosina considerada liviana. La cola se continua con un segmento llamado cuello que se une a una estructura de la molécula llamada cabeza, que es una estructura bífida. Al conjunto de la cabeza y cuello se le llama meromiosina pesada. El segmento de unión de la cola con la porción cuello-cabeza parece funcionar como una articulación y tiene cierto grado de movimiento. Cada cabeza tiene ATP y propiedades ATP-ásicas.
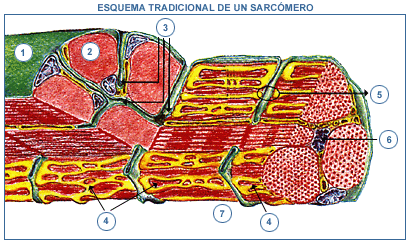
- En el esquema tradicional de un sarcómero, que normalmente se encuentra rodeado de un sistema membranoso, el retículo sarcoplasmático. Presenta en su centro una zona más obscura (banda A) formada por las bandas de miosina que esta separada, a cada lado, de las bandas z, por una zona más clara (banda I) ocupada por los filamentos de actina. En reposo, los filamentos de miosina están rodeados ordenadamente por filamentos de actina de modo que en los extremos de la banda A ambos tipos de filamentos coinciden aunque permanecen separados. Ello ocurre porque sobre los filamentos de actina se ubican dos proteínas, la troponina y la tropomiosina que constituyen un complejo que evita esa unión.
- La troponina es una proteína globular que se ubica, por pares, sobre el filamento de actina cada 40 nm. Cada troponina esta formada por tres subunidades:
- Troponina C, que tiene afinidad por el Ca2+
- Troponina T, unida a la tropomioisina,
- Troponina I, que inhibe la formación de puentes entre la miosina y la actina.
- Para activar este sistema, hacemos clic en el retículo sarcoplásmico. Cuando aumenta la concentración de calcio en el sarcoplasma, este se une a la troponina, lo cual provoca un cese del bloqueo ejercido por la tropomiosina y se forma un complejo actina- miosina el cual, estructuralmente, aparece como un puente.
- Al formarse el puente se activa la capacidad ATPásica de la cabeza de la miosina y el ATP presente en la cabeza de la miosina se disocia en ADP + Pi (fósforo inorgánico) proceso que requiere de una cierta cantidad de Mg2+.
- La salida de fosfato de la cabeza de la miosina provoca un giro o un movimiento de la cabeza lo cual hace que se desplace el filamento de actina a lo largo del de miosina hacia el centro del sarcómero. Esto significa que las bandas z también son arrastradas hacia el centro del sarcómero resultando en un acortamiento de esta estructura. Ello se traduce en una reducción o desaparecimiento de las bandas I.
- El ATP que se perdió de la cabeza de la miosina es recuperado a expensas del ATP del sarcoplasma. Al ocupar este su posición, la cabeza de la miosina se suelta de la actina y el sarcómero recupera su longitud inicial. Si ello no ocurre, es decir, cuando por alguna razón (muerte por ejemplo) no se repone el ATP en la cabeza de la miosina se presenta el fenómeno de rigidez.